STEADFAST
UNE ÉTUDE DE RECHERCHE CLINIQUE
ÉTUDE DE LA THÉRAPIE CELLULAIRE GÉNÉTIQUEMENT MODIFIÉE TX200 POUR LES PATIENTS RECEVANT UNE TRANSPLANTATION RÉNALE
IRT ET TRANSPLANTATION RÉNALE
L’insuffisance rénale terminale (IRT) est le dernier stade de l’insuffisance rénale chronique et survient lorsque les reins d’une personne ne fonctionnent plus. Une transplantation rénale est considérée comme la meilleure option de traitement de l’IRT. Une transplantation rénale ne peut pas avoir lieu sans la générosité d’un donneur d’organe, vivant ou décédé.
Après une transplantation rénale, le receveur doit prendre des médicaments immunosuppresseurs à vie pour supprimer son système immunitaire afin d’aider son organisme à accepter le rein transplanté. Généralement, ces médicaments ne ciblent pas le rein greffé lui-même, mais agissent pour supprimer l’ensemble du système immunitaire. Par conséquent, les médicaments immunosuppresseurs peuvent être associés à des effets secondaires tels qu’un risque accru d’infections ou d’autres affections graves.
En outre, les receveurs d’une greffe de rein doivent prendre ces médicaments immunosuppresseurs pendant toute la durée de vie du rein greffé. De ce fait, il est nécessaire de trouver une approche alternative pour aider l’organisme à accepter l’organe transplanté et à réduire le besoin de médicaments immunosuppresseurs.


iÉtude de phase I/IIa multicentrique, en ouvert, de détermination de dose, à dose unique croissante, visant à évaluer la sécurité et la tolérance d’une thérapie par lymphocytes T régulateurs autologues(a) exprimant un récepteur chimérique spécifique d’un antigène(b)(c) chez des receveurs de greffe de rein provenant d’un donneur vivant.
(a) Une thérapie autologue est un type de thérapie cellulaire qui utilise les propres cellules du patient.
(b) Les antigènes sont des substances que l’organisme peut reconnaître comme étrangères et contre lesquelles il peut former des anticorps. Les antigènes sont souvent des protéines situées à la surface des cellules.
(c) La thérapie par lymphocytes T régulateurs exprimant un récepteur chimérique spécifique d’un antigène est une nouvelle approche expérimentale utilisant un type de cellules T génétiquement modifiées avec des récepteurs synthétiques spécifiques d’un antigène.
QU’EST-CE LE TX200 ?
Le TX200 est une thérapie cellulaire expérimentale génétiquement modifiée développée pour les personnes recevant une transplantation rénale provenant d’un donneur vivant, où le receveur du rein est HLA-A2 négatif et le donneur est HLA-A2 positif. Dans l’ensemble, on estime que cette « incompatibilité » survient dans environ 20 à 25 % des transplantations d’organes.
On espère que le TX200 pourra potentiellement favoriser l’acceptation du nouveau rein par le système immunitaire du receveur, réduisant ainsi le besoin de médicaments immunosuppresseurs.
QU’EST-CE QU’UNE ÉTUDE CLINIQUE DE PHASE I/II ?
Un médicament expérimental ou médicament à l’étude est d’abord examiné chez un petit nombre de personnes dans des études cliniques de phase I/II afin d’évaluer sa sécurité et ses effets secondaires. Des évaluations scientifiques rigoureuses sont effectuées avant cette étape.
Une fois que la sécurité du médicament à l’étude est mieux comprise, il peut être évalué chez un plus un grand nombre de patients dans le but de continuer à surveiller sa sécurité et de examiner son efficacité. Tous les médicaments doivent passer par ces étapes très rigoureuses avant d’être en mesure de se voir accorder une autorisation de mise sur le marché et d’être prescrits aux patients.

QU’EST-CE QUE HLA-A2 ?
HLA-A2 fait partie d’une famille de protéines qui aident votre système immunitaire à distinguer le « soi » du « non-soi ».
Tout le monde n’a pas la protéine HLA-A2 dans son corps. Une personne est HLA-A2 positive si elle a la protéine HLA-A2 dans son organisme et HLA-A2 négative si elle n’en a pas.
Votre médecin sera en mesure de vous dire si vous êtes HLA-A2 positif/-ve ou négatif/-ve.
À propos de la transplantation rénale et du TX200
Cliquez ici pour en savoir plus sur les transplantations rénales et le TX200
LORSQUE LE RECEVEUR ET LE DONNEUR SONT « INCOMPATIBLES HLA-A2 »
Si un receveur du rein est HLA-A2 négatif et que le donneur est HLA-A2 positif, on dit qu’ils sont « incompatibles HLA-A2 ». Le système immunitaire du receveur pourrait reconnaître cette incompatibilité et cela peut potentiellement conduire l’organisme du receveur à rejeter le rein du donneur.
APERÇU DE L’ÉTUDE STEADFAST
STEADFAST est une étude clinique de phase I/II menée chez une population adulte (âgée de 18 à 70 ans) atteinte d’IRT et attendant de recevoir un nouveau rein d’un donneur vivant. L’étude est conçue pour évaluer la sécurité et la tolérance du produit expérimental TX200. La tolérance désigne le degré auquel les effets indésirables d’un médicament peuvent être tolérés par un individu.

QUE SONT LES CELLULES T RÉGULATRICES ?
Les cellules T régulatrices, également appelées lymphocytes T régulateurs ou « Tregs », sont un type de globules blancs spécialisés qui jouent un rôle important dans le bon fonctionnement du système immunitaire.
Dans le cadre d’une transplantation, les Tregs peuvent jouer le rôle de « casques bleus », en incitant d’autres globules blancs à cesser le feu. Cela garantit que le système immunitaire n’attaque pas par erreur l’organe transplanté sain tout en permettant aux globules blancs de protéger l’organisme contre les virus et les bactéries, par exemple.
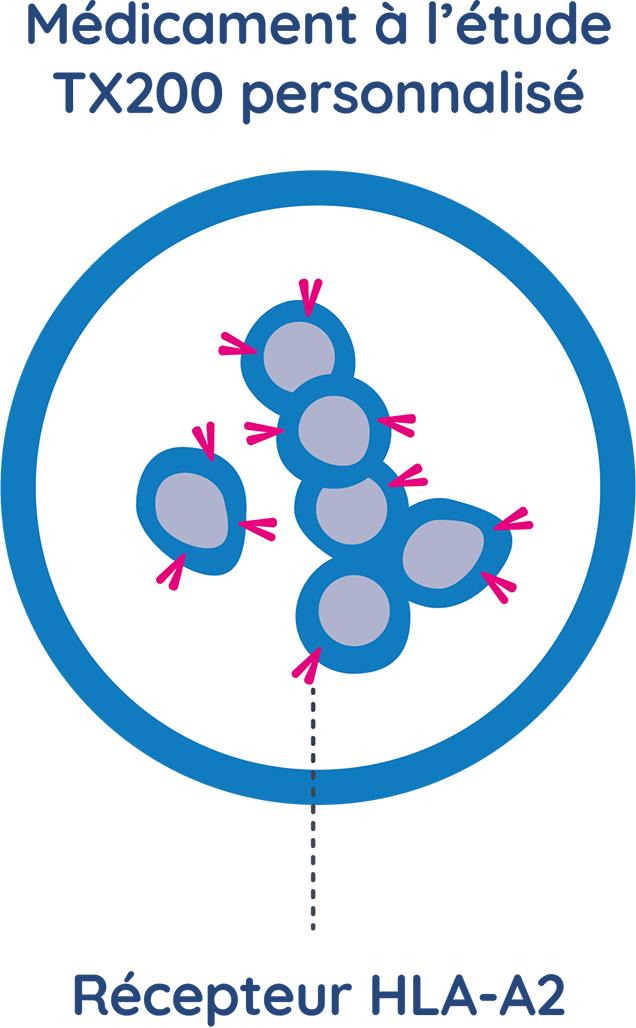
QUE CONTIENT LE TX200 ?
Le TX200 est une thérapie cellulaire expérimentale qui est réalisée à partir des propres cellules T régulatrices d’un participant ou d’une participante à l’étude. Les cellules du participant ou de la participante sont prélevées avant la transplantation et génétiquement modifiées pour leur permettre de reconnaître la protéine HLA-A2 du donneur.
Ensuite, ces cellules TX200 personnalisées sont réadministrées au participant ou à la participante après sa greffe. Le TX200 est spécifiquement conçu pour les patients qui sont HLA-A2 négatifs et qui attendent une transplantation d’un rein venant d’un donneur vivant HLA-A2 positif.
Le TX200 est fabriqué à l’aide des cellules T régulatrices ou Tregs, qui sont génétiquement modifiées pour leur permettre de reconnaître la protéine HLA-A2 sur le rein transplanté.
L’objectif du traitement par TX200 est d’aider l’organisme du patient ou de la patiente à accepter le rein du donneur, d’empêcher le système immunitaire de le rejeter et de lui permettre de bien fonctionner pendant une longue période.
Il n’existe pas encore de données prouvant que le TX200 aidera à l’acceptation du rein transplanté, ou indiquant s’il y aura des effets secondaires, car c’est la première fois que ce médicament à l’étude sera administré chez l’être humain. On ignore encore également la durée des effets du TX200. L’objectif de cette étude de recherche clinique est d’étudier les effets du TX200 chez l’être humain.
Le médecin de l’étude vous donnera tous les détails relatifs aux éventuels bénéfices et risques liés à la participation à l’étude et vous fournira ces informations par écrit.
Groupe TX200
Utiliser vos propres cellules pour fabriquer un médicament à l’étude TX200 qui vous est propre
Il existe deux groupes dans cette étude. Le groupe de participants « TX200 » recevra le médicament à l’étude TX200 en plus du suivi de routine et du traitement recommandé en vigueur. Le groupe de participants « témoin » ne recevra que le suivi de routine et le traitement recommandé en vigueur.
Les participants pourront faire partie soit du groupe TX200, soit du groupe témoin. Avant d’accepter de participer à l’étude, ils seront informés quant à leur groupe d’affectation.
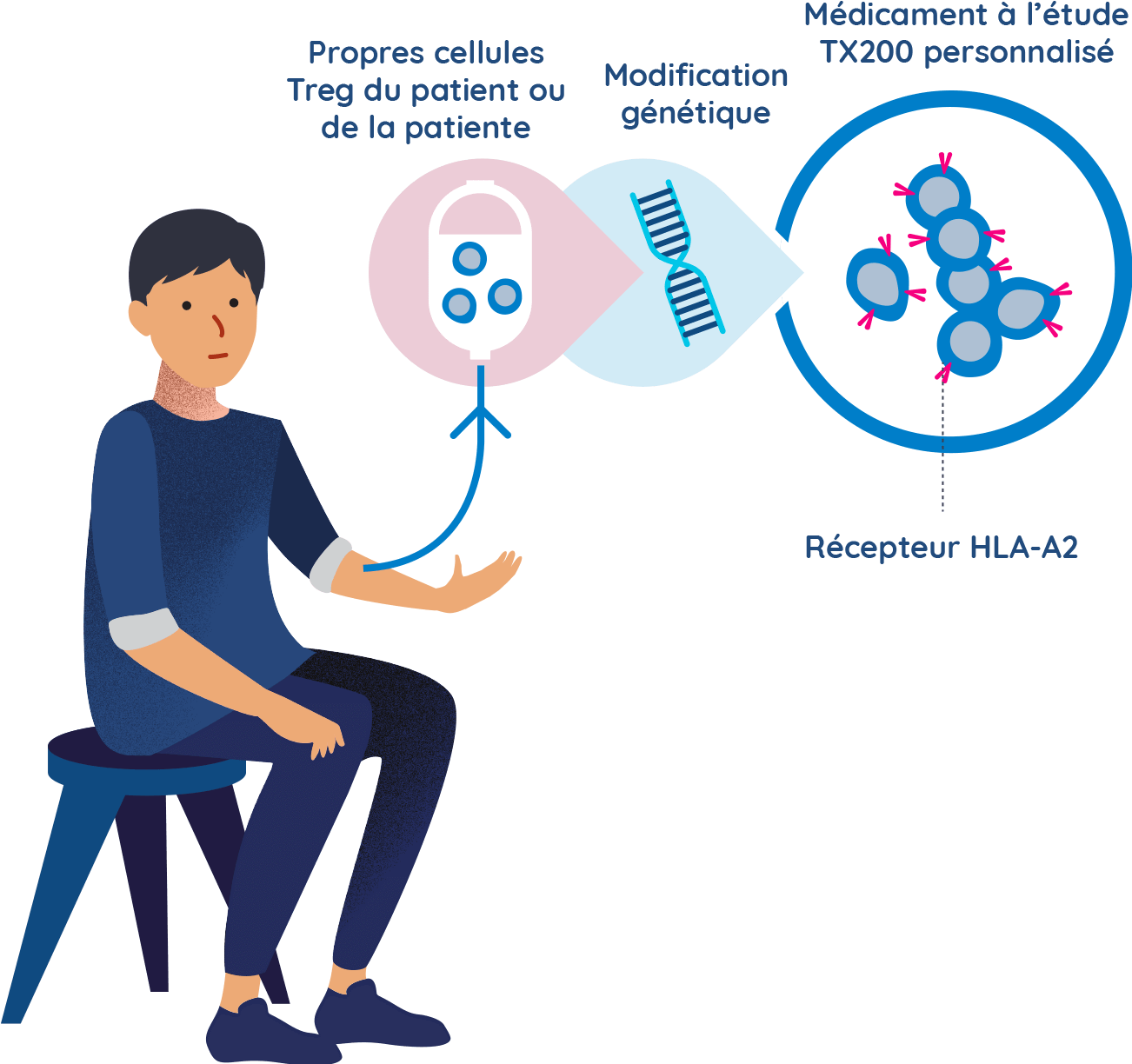
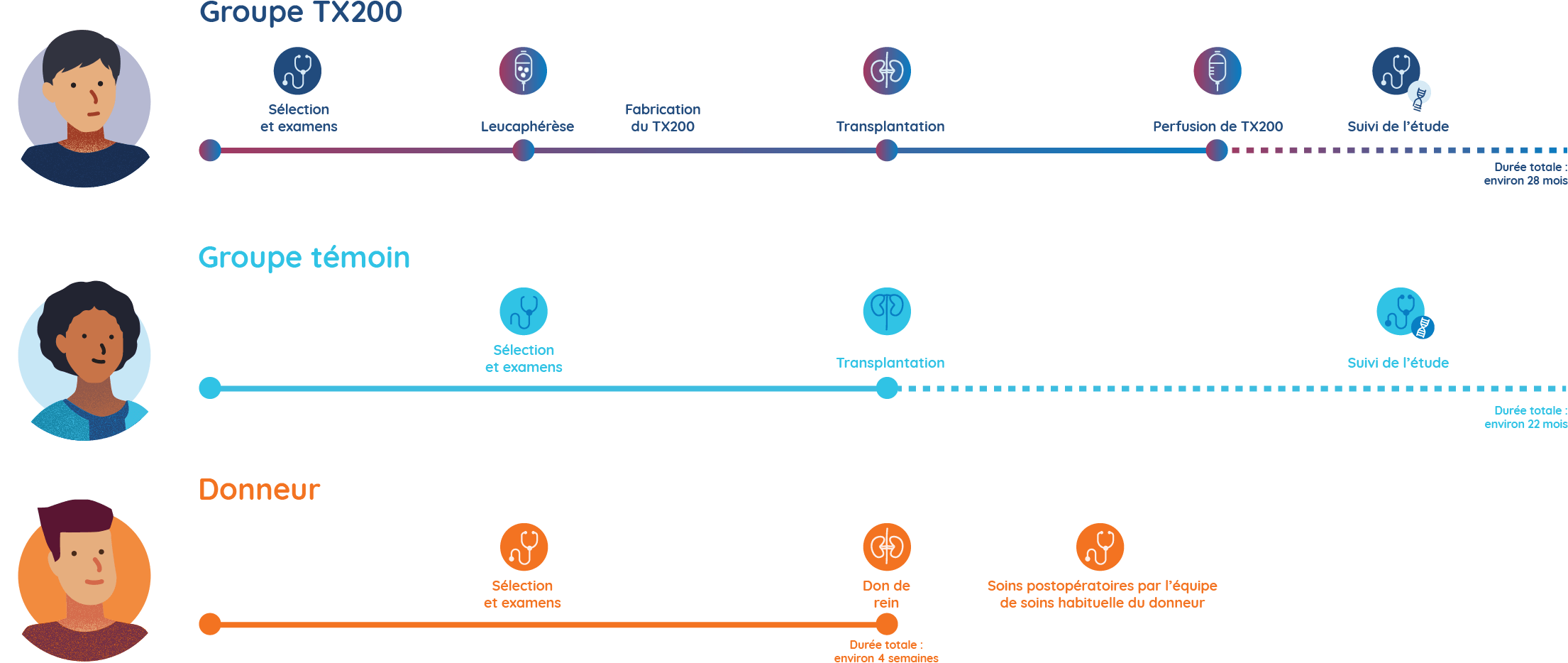
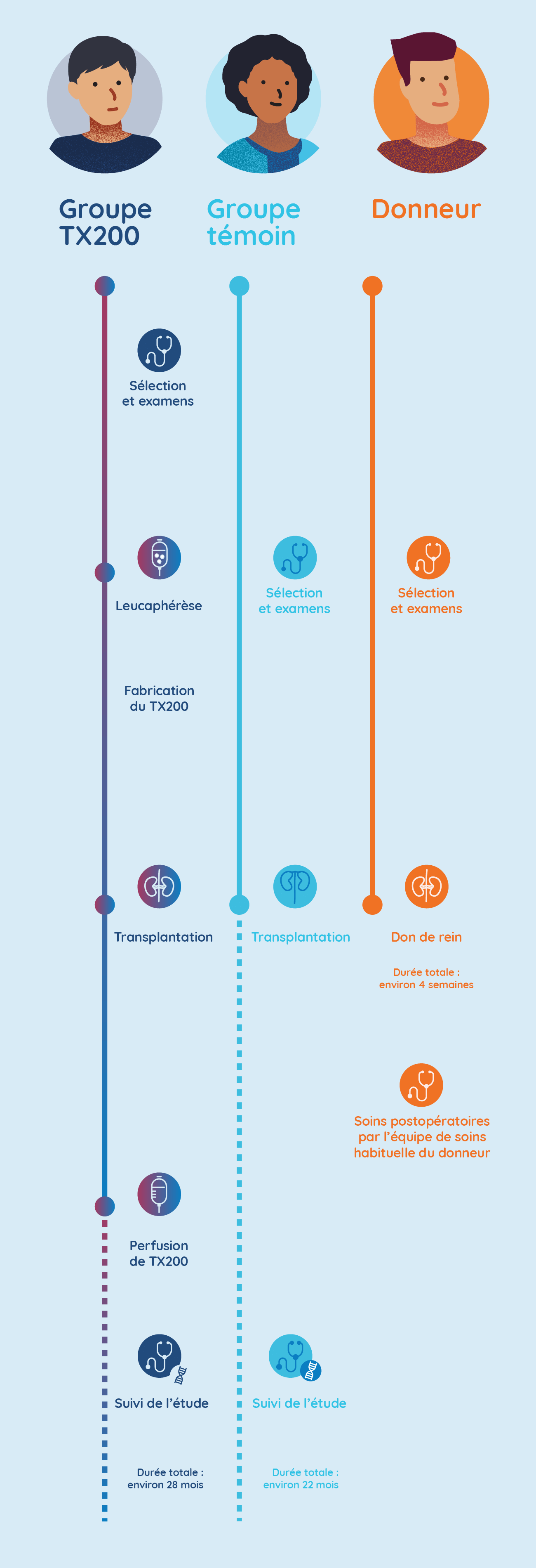
Les participants du groupe TX200 effectueront une leucaphérèse et leurs cellules Treg sont génétiquement modifiées
- Quelques semaines avant que la chirurgie de transplantation ne soit programmée, les participants affectés au groupe TX200 effectueront une procédure appelée leucaphérèse à l’hôpital. La leucaphérèse consiste à prélever certaines des cellules sanguines du participant ou de la participante. Il faut environ 3 à 5 heures pour la réaliser.
- Les cellules sanguines du participant ou de la participante du groupe TX200 seront ensuite traitées en laboratoire pour séparer ses cellules immunitaires spécialisées appelées cellules T régulatrices.
- Les cellules T régulatrices du participant ou de la participante du groupe TX200 seront alors génétiquement modifiées afin de leur permettre de reconnaître la protéine HLA-A2 qui sera présente sur le rein qui sera greffé au participant ou à la participante.
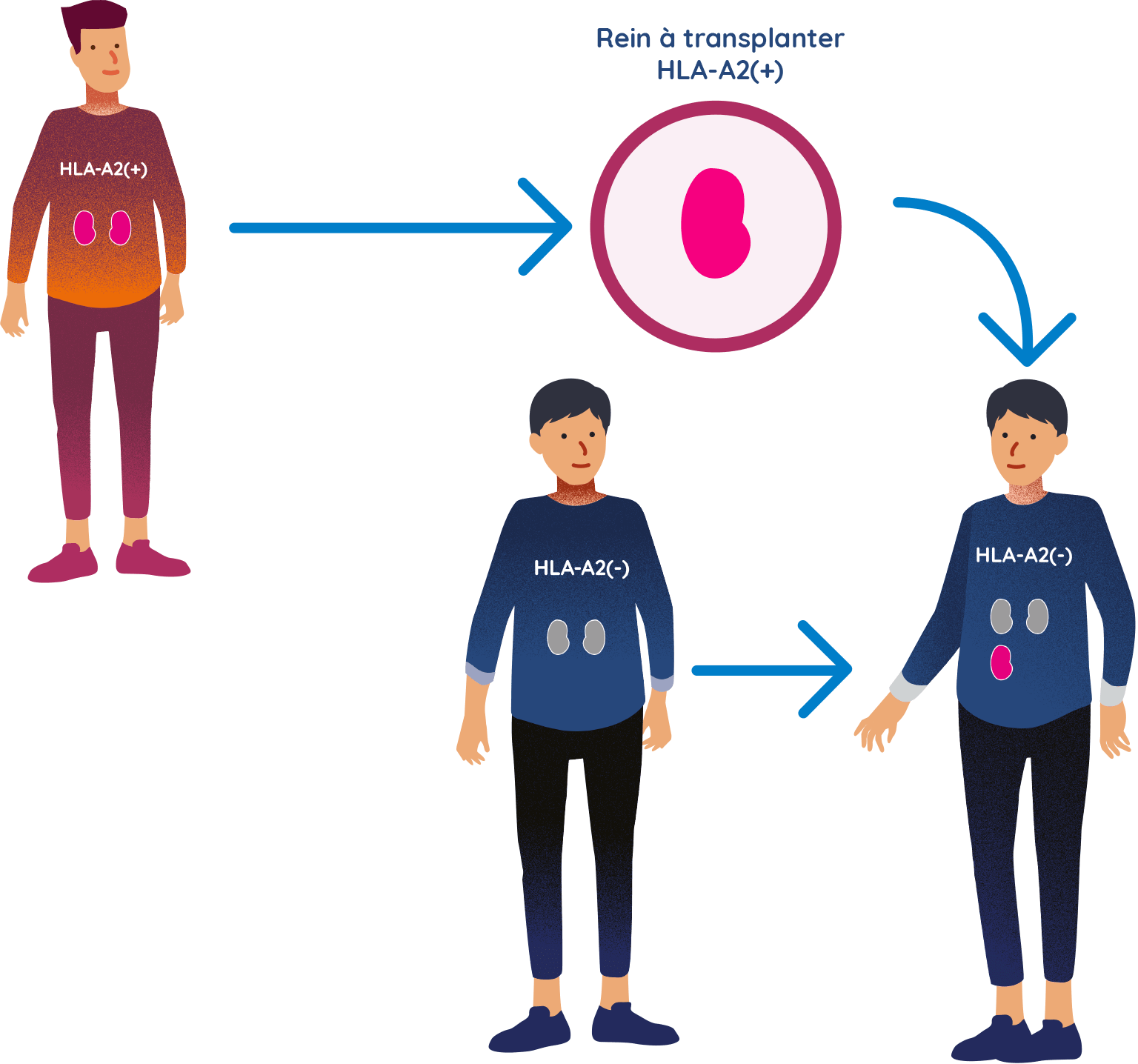
Les participants du groupe TX200 reçoivent le rein du donneur
- Le participant ou la participante du groupe TX200 recevra ensuite le rein de son donneur vivant qui est HLA-A2 positif. Il ou elle recevra un médicament immunosuppresseur standard à compter du jour de la transplantation rénale.
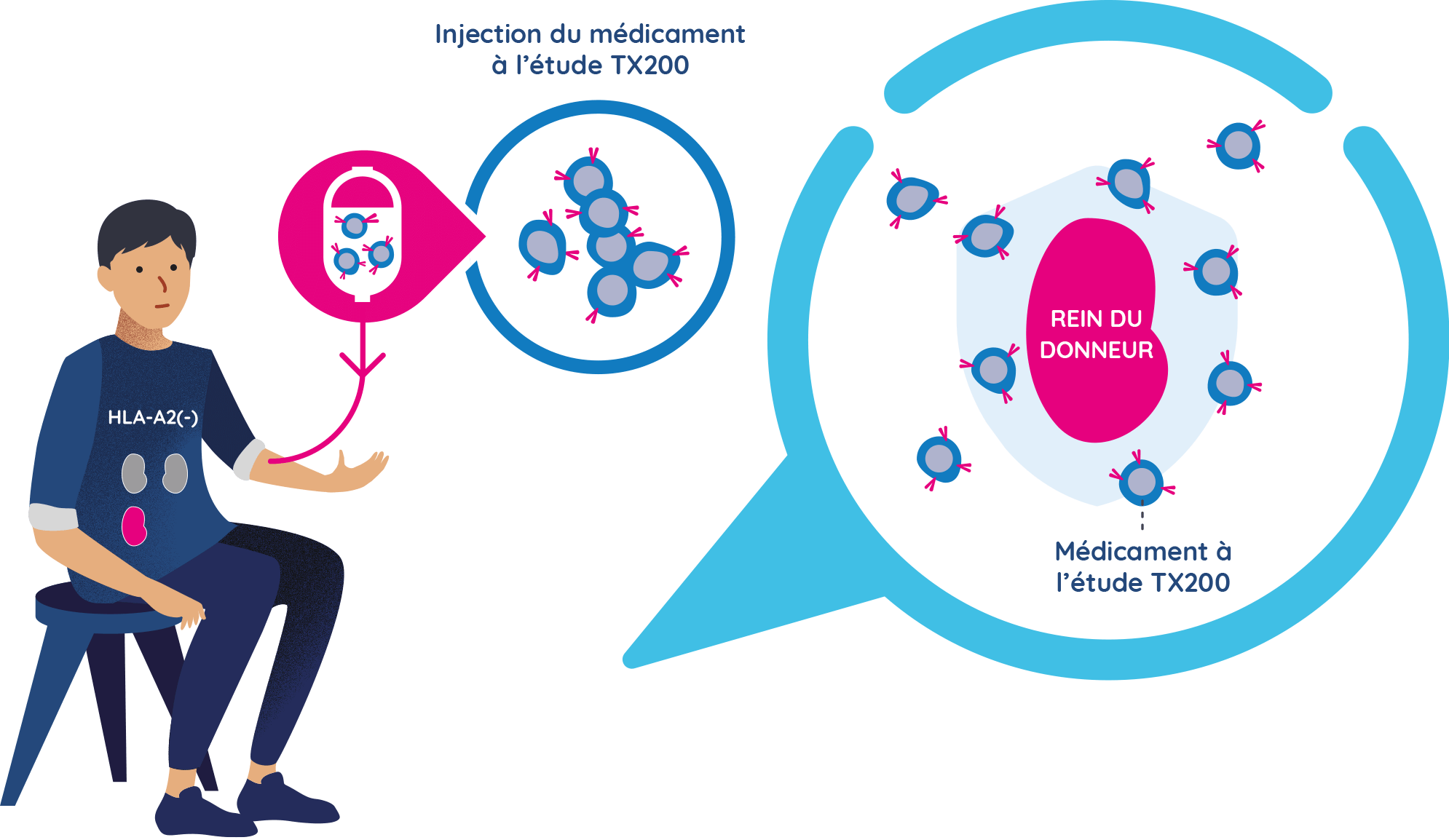
Les participants du groupe TX200 reçoivent leur médicament à l’étude TX200 personnalisé
- Environ trois mois après le don de rein, les participants du groupe TX200 recevront leur médicament à l’étude TX200 personnalisé à l’hôpital, sous forme d’injection dans le sang.
- Ils resteront à l’hôpital pendant 24 à 48 heures après l’injection de TX200 pour être surveillés de près. Chaque participant ou participante du groupe TX200 ne recevra qu’une seule injection de TX200.
- Une fois injecté, on s’attend à ce qu’un grand nombre de cellules TX200 se dirigent vers le rein transplanté, avec pour cible la protéine HLA-A2. En se fixant à la protéine HLA-A2 présente sur le rein du donneur, les cellules T régulatrices contenues dans le médicament à l’étude TX200 devraient s’activer. Une fois activées, les cellules T régulatrices devraient alors aider à éviter toute inflammation ou réponse immunitaire potentielle contre le rein transplanté.
- Le médecin de l’étude essaiera de réduire progressivement les doses des médicaments immunosuppresseurs, jusqu’à la plus faible dose possible pour chaque participant ou participante.

Pourquoi un groupe « témoin » est-il important ?
Il est important d’évaluer l’effet du médicament à l’étude en le comparant avec les traitements actuellement utilisés dans la pratique médicale courante. C’est la raison pour laquelle certains participants ne reçoivent pas le médicament à l’étude, mais continuent simplement avec les soins cliniques standard. Ils font partie du groupe témoin.
Les participants du groupe témoin recevront également une greffe de rein, avec les mêmes soins post-greffe et le même médicament immunosuppresseur de suivi. Par contre, ils n’effectueront pas de leucaphérèse et ne recevront pas de TX200.
Les donneurs peuvent contribuer à façonner l’avenir des patients recevant une greffe de rein.
Le donneur a un rôle extrêmement important dans cette étude, qui nous permettra d’évaluer la sécurité et l’activité du TX200 chez les receveurs de greffe. Elle aidera également les chercheurs à comprendre l’issue de la greffe de rein chez les participants ayant reçu le TX200 et chez ceux du groupe témoin.
Les donneurs seront surveillés de près et recevront des soins de soutien complets pendant la période de leur opération. Ils bénéficieront également d’un accès gratuit à tout traitement lié à leur participation à l’étude. Avant, pendant et après la chirurgie de transplantation rénale, les donneurs continueront à consulter leur médecin habituel et tout(e) spécialiste assurant leur suivi en temps normal.
Les donneurs seront informés si leur rein est greffé chez un participant ou une participante du groupe TX200 ou du groupe témoin. Quel que soit le groupe du receveur du don de rein (c’est-à-dire que la personne reçoive ou non le médicament à l’étude), la contribution du donneur aura un impact significatif sur la vie du receveur.
Étapes de l’étude STEADFAST
VOS CHOIX
Les progrès de la médecine dépendent de la participation des patients aux études cliniques. Nous vous encourageons à parler avec votre famille, vos amis et votre médecin traitant de votre éventuelle participation à cette étude. Chaque participant ou participante à l’étude STEADFAST contribue positivement à l’avenir des personnes recevant une greffe susceptible de leur sauver la vie.
Votre participation à l’étude doit être entièrement volontaire. Nous vous encourageons à parler avec votre famille, vos amis et votre médecin traitant de votre éventuelle participation à cette étude. Si vous acceptez de participer à l’étude, vous pouvez à tout moment revenir sur vos choix. Si vous décidez de vous retirer de l’étude, il est important que votre état de santé continue d’être surveillé, en particulier pour les participants du groupe TX200, car c’est la première fois que le TX200 est administré chez l’être humain et les effets à long terme sont encore inconnus.
OÙ TROUVER PLUS D’INFORMATIONS SUR L’ÉTUDE STEADFAST ?
Vous souhaiterez peut-être discuter de cette étude avec votre médecin, votre famille et vos amis pour avoir leur opinion avant de prendre une décision définitive quant à votre participation.
Si vous avez besoin de plus d’informations ou si vous souhaitez discuter plus en détail de l’étude STEADFAST, l’équipe de l’étude reste à votre disposition. Le médecin de l’étude pourra vous donner tous les détails relatifs aux éventuels risques et bénéfices liés à la participation à l’étude et pourra vous fournir ces informations par écrit.
Nous vous remercions de votre intérêt pour cette étude clinique. Ensemble, nous espérons que notre thérapie cellulaire génétiquement modifiée, le TX200, pourra nous aider à augmenter les chances de réussite de la transplantation rénale.
À PROPOS DE SANGAMO
Sangamo Therapeutics est une société de médecine génomique implantée aux États-Unis, en Angleterre et en France. Notre mission est de mettre en œuvre nos activités de recherche innovantes pour développer des médicaments génomiques pouvant transformer la vie des patients à l’aide de la thérapie génique, la thérapie cellulaire et l’ingénierie du génome. Pour plus d’informations sur Sangamo, rendez-vous sur sangamo.com.
À PROPOS DE LA PANDÉMIE DE COVID-19
Pendant la pandémie de coronavirus, l’identification et le dépistage d’une éventuelle infection à la COVID-19 seront effectués à certains moments de l’étude. Par ailleurs, certaines visites de l’étude pourront être effectuées à distance, chez vous ou par téléphone.
Pour plus de détails sur l’étude, consultez le registre des essais cliniques de l’UE ou clinicaltrials.gov et parlez-en avec l’équipe de l’étude.
